コラム
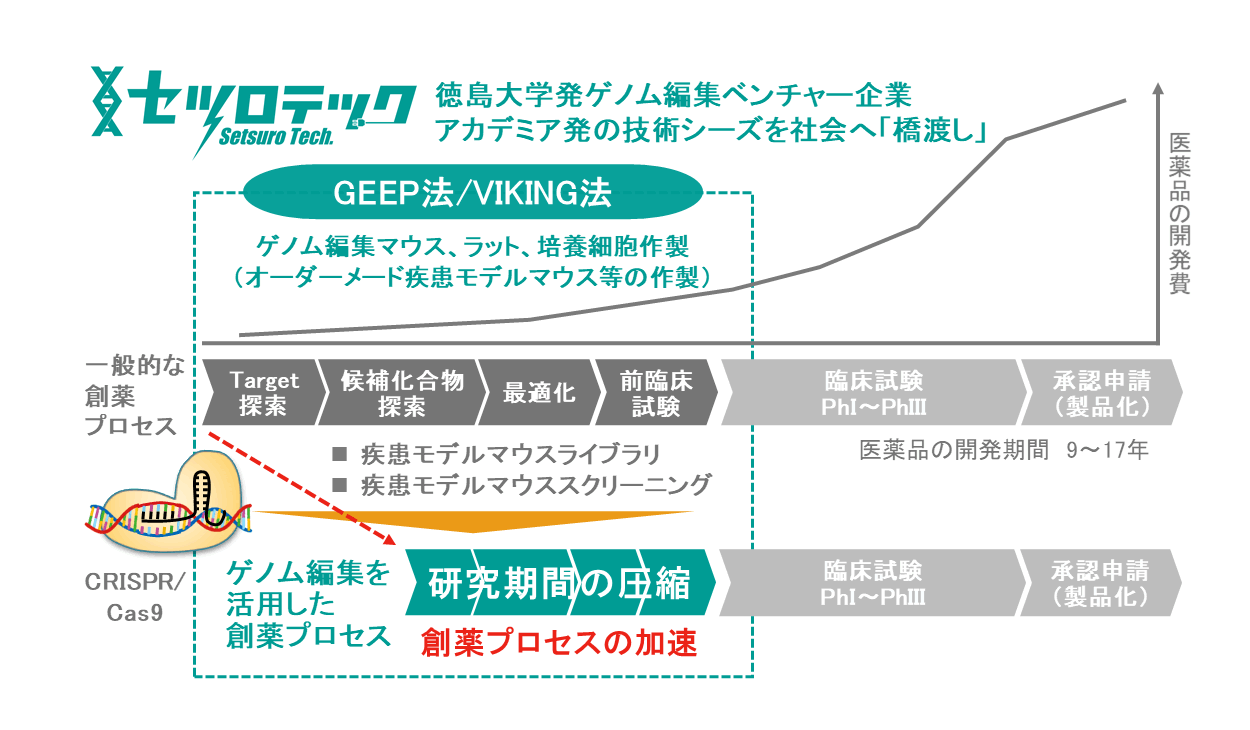
徳島発のゲノム編集技術で創薬プロセスを加速させる
基礎研究から非臨床試験、臨床試験と続く一連の医薬品開発プロセスにおいて、ゲノム編集技術は、あらゆるところで革新的な飛躍をもたらしており、また技術そのものも日進月歩の発展を見せています。特に、2020年のノーベル化学賞の受賞対象となったCRISPR/Cas9システムによるゲノム編集は、ノックアウトマウスや疾患モデルマウスの作製を大幅に効率化し、様々な創薬研究・非臨床試験で利用されています。弊社セツロテックは、徳島大学発の独自のゲノム編集技術シーズを発展させ、知財を創造し、事業として社会への「橋渡し」を目指す企業として、基礎研究が実用化へと実るまでのあらゆる研究活動を支援しています。
![]() 株式会社セツロテックは、徳島大学の教員でもある竹本龍也、沢津橋俊らが、2017年に設立した徳島大学発スタートアップ企業です。主に、竹本らが開発し、特許を出願した「受精卵エレクトロポレーション法(GEEP 法、特開2017-184639)」、また沢津橋らが開発し、特許出願中の「VIKING法(特開2018-126122)」という、ゲノム編集のハイスループットを実現する2つの技術を基盤としています。
株式会社セツロテックは、徳島大学の教員でもある竹本龍也、沢津橋俊らが、2017年に設立した徳島大学発スタートアップ企業です。主に、竹本らが開発し、特許を出願した「受精卵エレクトロポレーション法(GEEP 法、特開2017-184639)」、また沢津橋らが開発し、特許出願中の「VIKING法(特開2018-126122)」という、ゲノム編集のハイスループットを実現する2つの技術を基盤としています。
GEEP(Genome Editing by Electroporation of Cas9 Protein)法は、Cas9タンパク質及びgRNAといったゲノム編集ツールを、電気の力(エレクトロポレーション)によって受精卵に導入する方法です[1-3]。従来、遺伝子改変マウスを作製する際には、主にマイクロインジェクション法が用いられてきました。マイクロインジェクション法は、ガラスキャピラリーという非常に細いガラス管を用いて、顕微鏡下で受精卵一つ一つに溶液を注入する方法で、専用の設備と高度な胚操作技術が求められます。一方、GEEP法では、必要な技術は受精卵を電極に並べることのみであり、受精卵一つ一つに対する煩雑な作業を介すことなく、一度に複数個(20個〜 200個)の受精卵へゲノム編集ツールを導入することができます。このように、ゲノム編集ツールをハイスループットかつ低コストに導入できるGEEP法を活用することで、短時間で均一な条件下で、大量の受精卵に対して低侵襲にゲノム編集を行えるというメリットを産み出し、高効率なゲノム編集生物の作製が期待できます。また、弊社の竹本(徳島大学)らは共同研究にて、ブタの表現型改変にGEEP法を活用した研究も報告しており[3]、マウス以外の幅広い動物への応用も期待できます。
VIKING(Versatile NHEJ-based Knock-in using genome editing)法は、培養細胞のゲノム編集法において、従来利用されてきた相同組換え修復経路でなく、より高頻度に起こる非相同末端結合(NHEJ)修復経路を利用したゲノム編集法です[4]。VIKING法では、煩雑なドナーベクター構築作業を省略するために、ゲノム編集ツールの導入に必要なベクターを組み合わせたノックインモジュールを開発しており、遺伝子導入可能な細胞において、簡便に高効率なノックインゲノム編集を実現可能です。VIKING法の特徴としては、ウイルスベクターでは困難な10kbpを超える大型ベクターの挿入ができること、薬剤耐性遺伝子などのマーカーとなる配列がゲノム配列に挿入されることにより、ゲノム編集後の細胞のセレクションが容易になることがあげられます。また、VIKING法では、使用する3つのベクターの導入比率を最適化することにより、意図しない配列改変(ランダムインテグレーション)を劇的に低減することに成功しました。ターゲットを遺伝子のコーディング領域とした場合にはドナーベクターの挿入による遺伝子破壊株の樹立が、ターゲットをAAVS1などのセーフハーバー座位をターゲットにした場合はノックインによる安定発現株の樹立が可能であり、様々な細胞種での使用実績もございます。弊社では、現在VIKING法が苦手な数塩基の欠失や点変異のご要望にも対応するため、VIKING法以外のゲノム編集法についても、積極的に社内研究を進めております。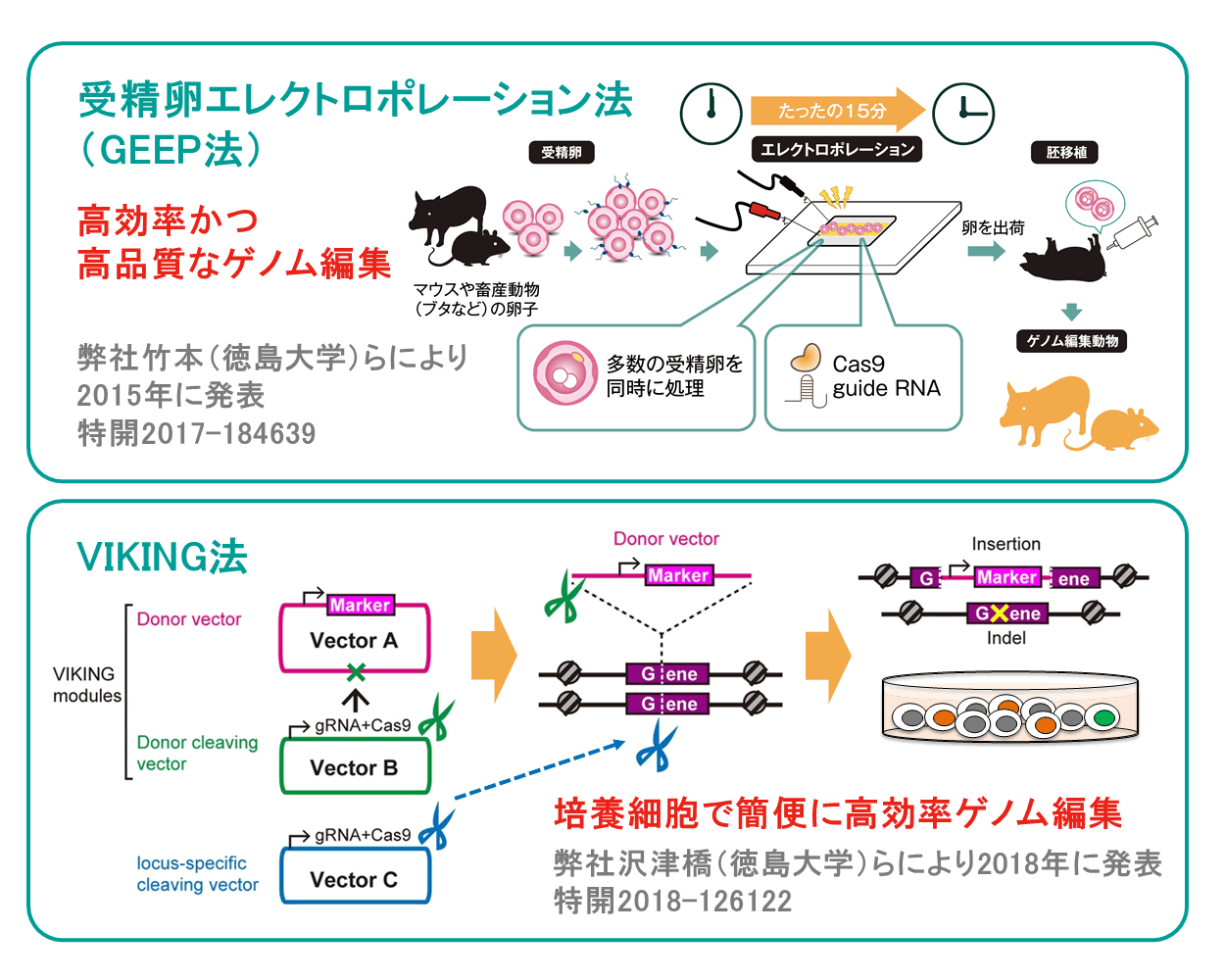
弊社は、これらの技術を活用した遺伝子改変マウス・培養細胞の受託作製サービスを展開しているほか、産業界にもゲノム編集生物を提供する基盤的な企業として、広くゲノム編集産業を開拓し、もって世界中の人々の暮らしを豊かにすることを目標としています。弊社の研究支援事業におけるゲノム編集マウス・ラット・培養細胞の受託作製サービスは、創業から4年の間で様々な研究者の方にご利用いただいており、幸いにも多くの方のご好評を得ております。実際に、弊社のサービスが貢献した論文も多数報告されており、例えば、弊社で作製したGdpd3ノックアウトマウスの解析結果を含む、広島大学原爆放射線医科学研究所の仲一仁准教授の研究成果が、英国科学誌 Nature Communications に掲載されました(2020)[5]。この研究では、慢性骨髄性白血病(CML: chronic myelogenous leukemia)のチロシンキナーゼ阻害剤(TKI: tyrosine kinase inhibitor)治療後の再発原因であるCML幹細胞に着目した研究を行い、Gdpd3によるリゾリン脂質代謝制御がCML幹細胞の生存維持に重要な役割を担うことを解明しています。仲先生によれば、「今後、Gdpd3を阻害する分子標的薬を開発できれば、TKIと併用することでCML患者の再発をさらに改善できる可能性がある」とのことで、まさに将来の実用化に向けたシーズとして、トランスレーショナルリサーチの対象となる研究成果です(詳しくは弊社Webサイトの紹介記事をご参照ください[6])。
このように、ゲノム編集技術は、研究者の独自のアイデアを具体化して検証するツールとして、非常に強力なパワーがあります。しかし、そのビジネスの可能性の大きさのゆえに、米国ではいまだ特許紛争が続いており、複雑な状況になっているのが現状です。弊社は、こうした不安を解決するため、日本国内の研究支援での利用に関しては、Broad InstituteおよびERS Genomicsの双方とCRISPR/Cas9ライセンス契約を締結しており、安心してサービスのご利用が可能です。弊社の独自のゲノム編集技術は、研究者にゲノム編集モデルを迅速かつ比較的低コストで提供することを可能にします。基礎研究から、疾患モデルを利用したスクリーニング、さらにはゲノム編集マウスを利用した非臨床試験まで、これからもセツロテックは、創薬に携わる様々な研究者を支援してまいります。
- Hashimoto M, Takemoto T. Electroporation enables the efficient mRNA delivery into the mouse zygotes and facilitates CRISPR/Cas9-based genome editing. Sci Rep. 2015; 5:11315.
- Hashimoto M, Yamashita Y, Takemoto T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 2016; 418(1):1-9.
- Tanihara F, Takemoto T, Kitagawa E, et al., Somatic cell reprogramming-free generation of genetically modified pigs. Sci Adv. 2016;2(9):e1600803.
- Sawatsubashi S, Joko Y, Fukumoto S et al., Development of versatile non-homologous end joining-based knock-in module for genome editing. Sci Rep. 2018; 8(1):593.
- Naka K, Ochiai R, Matsubara E, et al., The lysophospholipase D enzyme Gdpd3 is required to maintain chronic myelogenous leukemia stem cells. Nat Commun. 2020; 11(1):4681.
- 【導入事例】ゲノム編集ノックアウトマウスを用いた、がん幹細胞のリゾリン脂質代謝の意義の解明(広島大学 仲先生)https://www.setsurotech.com/media/case_210210/
2021年7月
株式会社セツロテック
代表取締役 竹澤慎一郎