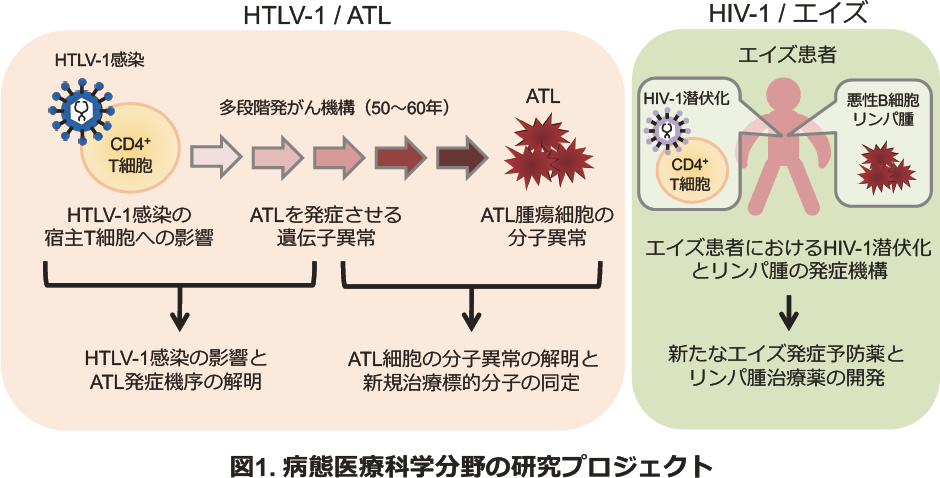
私たちの研究室では、ヒトレトロウイルスHuman T cell Leukemia Virus type I (HTLV-1)の感染により引き起こされる成人T細胞白血病・リンパ腫(Adult T cell leukemia, ATL)やHTLV-1関連脊髄症(HTLV-1 associated myelopathy, HAM)を対象に、HTLV-1感染の宿主T細胞への影響、多段階発がん機構、ATL腫瘍細胞やHAMの分子異常の3つの課題を柱に研究を行っています。特にHTLV-1感染とATL発症に伴うゲノム異常、エピゲノム異常、遺伝子発現異常を統合解析し、HTLV-1感染予防、ATL発症予防、そしてATLやHAMに対する新たな治療薬の開発に役立てることを目指しています。また、他の悪性リンパ腫や、HTLV-1と同じヒトレトロウイルスHIV-1によるエイズの分子病態についても研究を進めています(図1)。
また私たちの研究室はHTLV-1感染対策の政策研究の拠点の一つという性格も持っています。全国に100万人以上いるHTLV-1キャリアの現状の評価と対策の検討などを行うとともに、HTLV-1キャリアコホート研究(JSPFAD:Joint Study of Predisposing Factors on ATL Development: http://www.htlv1.org/)を中心的に運営しています。また厚生労働省の研究班の活動として、HTLV-1キャリアの実態調査と情報提供のためのウェブサイト「キャリねっと」(https://htlv1carrier.org/)の運営を行い、HTLV-1感染対策の政策研究を行っています。
研究のテーマとこれまでの成果
(1) HTLV-1感染が宿主T細胞に及ぼす影響の解明
(2) ATL発症に伴う遺伝子発現異常の解析
(3) HTLV-1関連疾患に対する新たな治療法、発症予防法の開発
(4) HIV-1、エイズ関連疾患の研究
(1) HTLV-1感染が宿主T細胞に及ぼす影響の解明
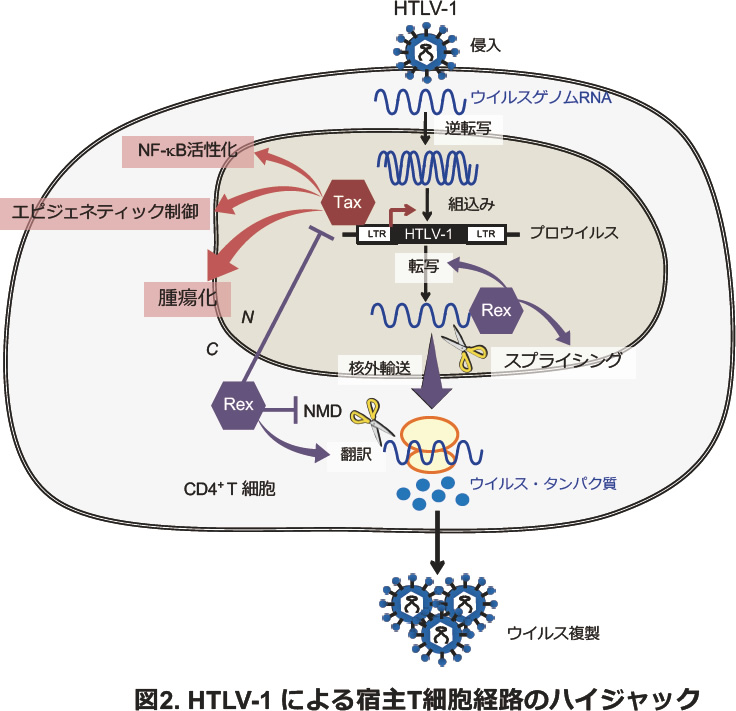
HTLV-1は感染後、ゲノムRNAの逆転写および2本鎖DNA合成を経て、感染T細胞のゲノムに組み込まれ、プロウイルスと呼ばれる状態になります。プロウイルからはまずTaxとRexというウイルス機能タンパク質が発現し、ウイルス複製を開始します。ウイルス複製ではTaxがプロウイルス・プロモーターLTRを活性化し、ウイルスmRNAを大量に転写させます。RexはこれらのウイルスmRNAに特異的に結合し、核外に輸送することにより、細胞質におけるウイルスタンパク質の翻訳とウイルス再構築を促進します。Taxは細胞を腫瘍化する力を持っており、感染細胞形質に多大な影響を与えることが分かっています。RexがTaxの活性をコントロールし、ウイルスの活発な複製とそれに続く潜伏状態への移行のタイミングを決めていると考えられています。
当研究室ではさらに、これらのウイルス機能タンパク質が、感染細胞内の様々な経路に介入していることを発見してきました。TaxはLTRを活性化してウイルス遺伝子発現を活性化するだけでなく、NF-κBなどの細胞内転写因子やEZH2などのエピジェネティック制御因子と相互作用し、宿主エピゲノムをリプログラミングすることで、前癌状態にある感染細胞集団を形成させることを明らかにしました。またRexは、宿主細胞のmRNA品質管理機構(nonsense-mediated mRNA decay: NMD)を抑制し、不安定なウイルスRNAを安定化することにより、ウイルス複製を促進させていることが分かりました。 さらにRexと細胞内タンパク質の相互作用を詳しく解析したところ、転写因子、mRNAスプライシング機構や翻訳機構を制御するタンパク質と相互作用することが明らかになり、Rexがこれらの様々な細胞内経路に作用している可能性が示されました。このように、HTLV-1がコードするタンパク質が感染細胞内の様々な経路をハイジャックし、また互いに調節し合うことによって、ウイルス複製に有利な細胞内環境を整備している様子が分かってきました(図2)。
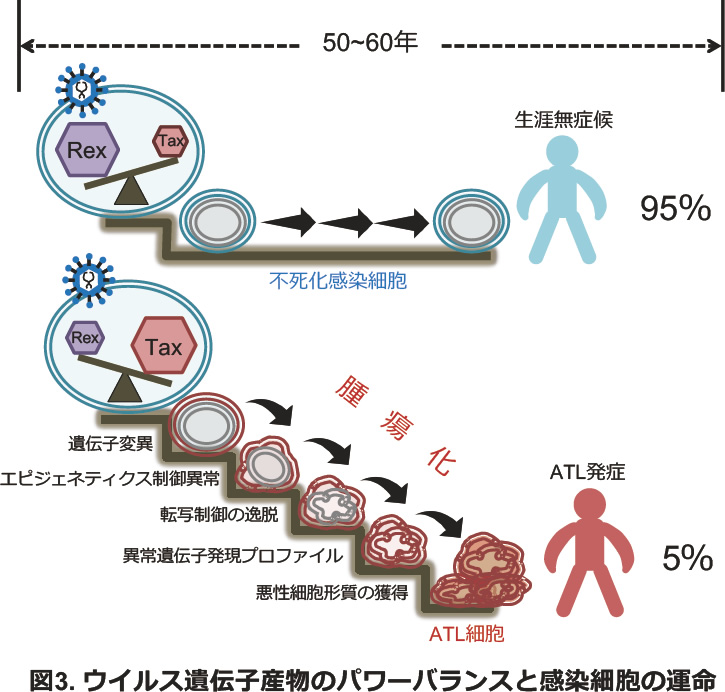
このようなTaxやRexによるウイルス複製は、感染後数日で終了し、感染細胞はやがて不死化し、慢性潜伏状態に移行します。潜伏した感染細胞ではTaxやRexは発現していないと考えられています。ほとんどの感染細胞は、安定した潜伏状態を長期間にわたって維持し、HTLV-1感染者のうち約95%は生涯無症候のまま過ごします。一方で、約5%の感染者の感染細胞は、50〜60年の間に徐々に異常を蓄積し、腫瘍化してしまいます。これがATLの発症です。なぜ一部の感染細胞が腫瘍化してしまうのかは、未だ分かっていません。その理由の一つとして、私達は感染初期のTaxやRexといったウイルス遺伝子産物のパワーバランスが関係していると考えています(図3)。これらのウイルス遺伝子産物が感染細胞をハイジャックしてウイルス複製を行う際に、それぞれの機能や活性がバランス良く機能し、感染細胞内に「傷跡(異常)」を残さなければ、その後長期に渡って安定した潜伏状態を維持できます。現在この可能性を検討するために、TaxやRexが相互にどのように影響し合っているか、研究を進めています。
主な参考論文:
- Nakano and Watanabe, Front. Microbiol. 3:330, 2012
- Nakano et al., Microbes Infect. 15:491-505, 2013
- Nakano and Watanabe, Viruses 8: 58, 2016
- Fujikawa et al., Blood, 127: 1790-1802, 2016
- Yamagishi et al., Front. Microbiol. 9:1686, 2018
(2) HTLV-1関連疾患のゲノム、エピゲノム、遺伝子発現異常の臨床統合解析
これまで私たちの研究室では、HTLV-1感染者とATL患者の血液検体での遺伝子発現プロファイルやスプライシング異常の実態を網羅的に解析してきました。その結果、HTLV-1がT細胞に感染し、さらにATL細胞への進展に伴い、感染細胞内では多くのmRNAやmicroRNAの発現量が劇的に変化すること、また異常なスプライシングを受けたバリアントmRNAが細胞内に蓄積していくことが明らかになりました。
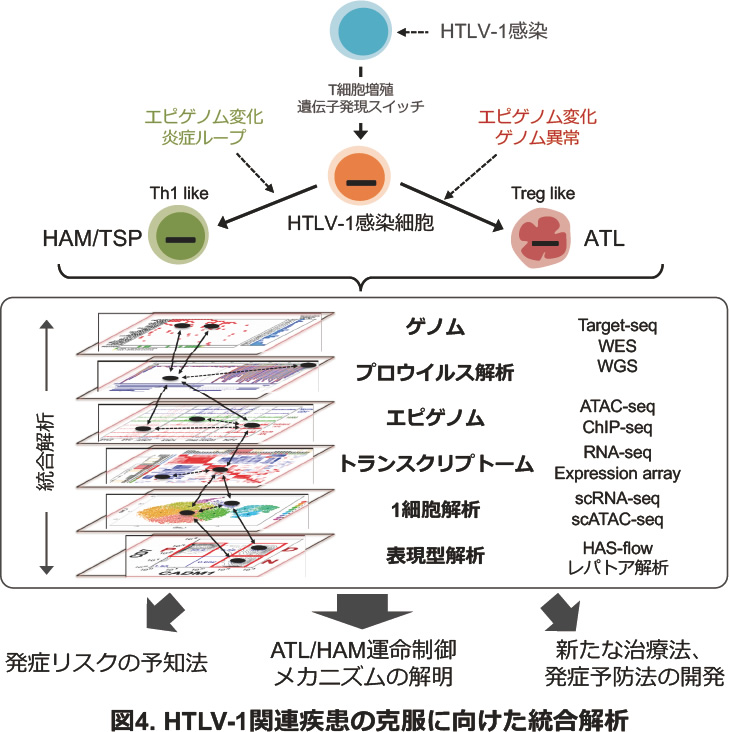
さらに最近では、HTLV-1感染細胞を精密に検出/分取できるHAS-Flow法を用いてATL患者、HAM患者、無症候性HTLV-1キャリアの方々のHTLV-1感染細胞を分取し、次世代シークエンサー技術を用いてゲノム異常(WGS, WES, Target capture-seq)、エピゲノム(ChIP-seq, ATAC-seq)、遺伝子発現解析 (RNA-seq)、1細胞解析(single-cell RNA-seq, single-cell ATAC-seq)などの多層的オミックス統合解析を実施しています。これらの研究成果から、HTLV-1感染により、共通した疾患発症につながる遺伝子発現パターンの異常が早期に形成され(共通前駆細胞)、これらがエピジェネティックな異常などにより疾患発症運命の制御を受け、遺伝子変異を蓄積して腫瘍化の過程が進行する、もしくは炎症ループの形成によりHAMを発症する、という新たなコンセプトを導きました。このように、臨床データと紐づけたデータベースを構築し、ビッグデータから発症メカニズムの解明を目指すとともに、早期診断、発症予防、新規治療法開発につながる新たな情報の発信を行っています(図4)。
主な参考論文:
- Yamagishi et al., Cancer Cell, 21:121-135, 2012
- Kobayashi et al., Clin. Cancer Res., 20:2851-2861, 2014
- Firouzi et al., Blood Adv., 1:1195-1205, 2014
- Fujikawa et al., Blood, 127: 1790-1802, 2016
- Nakano et al., Clin. Cancer Res., 22: 5915-5928, 2016
- Nakano et al., Mol. Cancer Res. 17: 2522-2536, 2019
- Nagasaka et al., Proc. Natl. Acad. Sci. U S A. in press
(3) HTLV-1関連疾患に対する新たな治療法、発症予防法の開発
基礎研究の成果は、すでに新たな治療法の開発に繋がっています。
正常T細胞とATL細胞のエピゲノム変化を解析した結果、EZH1/2を中心としたヒストンメチル化酵素複合体(Polycomb repressive complex; PRC)の異常な活性と分布により、ゲノムワイドなエピジェネティック異常が存在することが明らかにしました。またその下流でmicroRNA群の発現変動やNF-κB経路、Hedgehog経路などの活性化が起こることも明らかにしました。さらに産学官連携による新規EZH1/2分子標的治療薬の開発に成功しました。当研究室の成果を経て、現在悪性リンパ腫などに対する複数の臨床試験が実施されています。基礎医学/生物学と臨床研究を結ぶトランスレーショナルリサーチの実例としても注目されています(図5)。
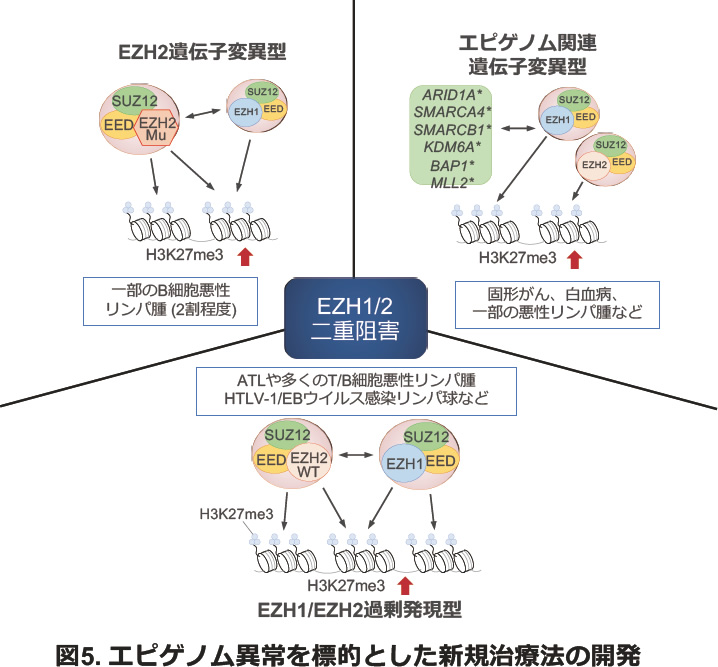
主な参考論文:
- Yamagishi et al., Cancer Cell, 21:121-135, 2012
- Takahashi et al., Cancer Sci. 105: 1160-1169, 2014
- Fujikawa et al., Blood, 127: 1790-1802, 2016
- Yamagishi M and Uchimaru K. Curr. Opin. Oncol. 29: 375-381, 2017
- Yamagishi et al., Cell Rep., 29: 2321-2337, 2019
また、一部の悪性リンパ腫に発現が認められるCD30の機能的シグナルがATLの病態進展と関連しうることを見出しました(図6)。CD30をターゲットとした抗体医薬は近年多くの悪性リンパ腫に対して適応承認されています。本薬剤の適切な投与法を見据えたトランスレーショナルリサーチを進めています。
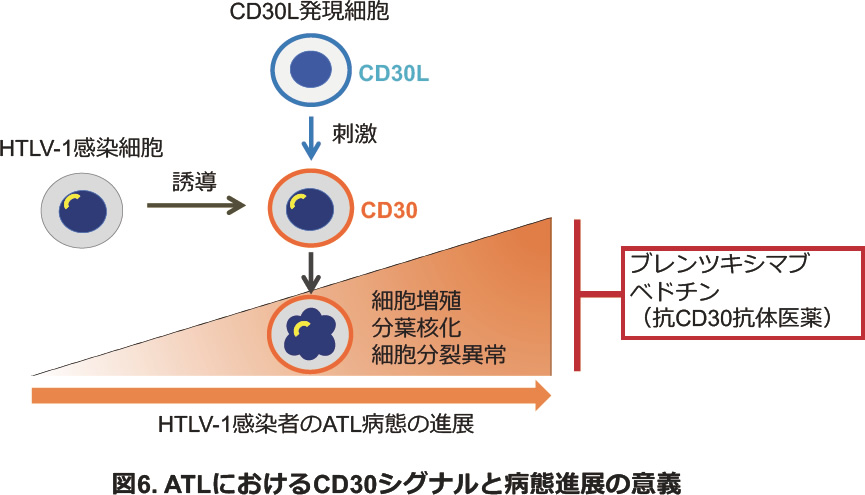
主な参考文献
- Nakashima et al., Clin. Cancer Res., 21:5445-5457, 2018
- Nakashima et al., Biol Cell, 5:109-124, 2018
(4) HIV-1、エイズ関連疾患の研究
エイズは世界の死亡原因の第6位(2012年,WHO)です。当研究室では、HIV-1感染症の根治を妨げるHIV-1の潜伏化と、エイズ患者に高頻度に合併する悪性リンパ腫にも焦点をあて、エピジェネティクス、microRNA、シグナル伝達経路の観点から研究を進め、新規治療法の開発に取り組んでいます。
参考文献:
- Matsuda et al., Sci. Rep. 5:7701, 2015
- Yamagishi et al., Sci. Rep. 5:17868, 2015

