細胞膜ブレブの形成退縮に関わるシグナル伝達機構の解明
 研究代表者
研究代表者
池ノ内順一
九州大学 理学研究院
http://www.biology.kyushu-u.ac.jp/~taisha/
研究概要
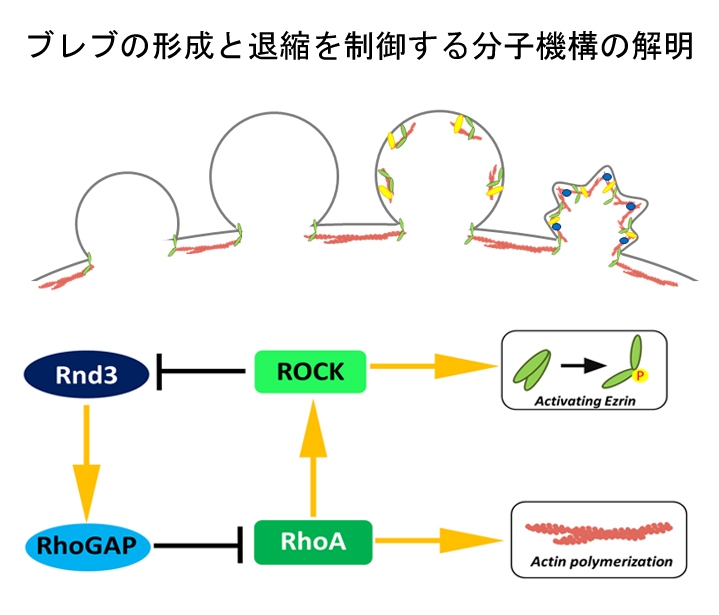
細胞膜は恒常的にアクチン細胞骨格に裏打ちされています。アクチン細胞骨格が一時的に細胞膜から解離すると、細胞膜は細胞内圧によって突出します。このような細胞膜の突出構造をブレブと呼びます。ブレブは細胞死や細胞分裂の際に観察されますが、近年、細胞は能動的にブレブを形成して方向性を持った運動することが明らかになりました。ゼブラフィッシュの始原生殖細胞が移動する際にブレブを用いて移動していること(Blaser et al. Dev Cell 2006)が示されて以降、細胞性粘菌などの下等生物から、近年では、ヒトの癌細胞もブレブによって細胞が運動性を獲得すること(Liu et al. Cell 2015)が報告されています。いずれの細胞も、ブレブの形成と退縮を繰り返しながら運動します。しかしながら、ブレブの分子機構には不明な点が多く残されています。私たちは、ブレブの形成・退縮に関わる分子機構の解析を進めてきました(Aoki et al. PNAS 2016)。これまでにブレブが形成されて細胞膜が拡大する時期においては低分子量Gタンパク質Rnd3がp190B-RhoGAPの活性化を介してRhoAの活性を抑制するのに対して、ブレブが退縮する時期においては、RhoAが活性化されて、ROCKがRnd3を直接リン酸化することによりRnd3を形質膜から排除するという、RhoAとRnd3の相互抑制機構が存在することを明らかにしました。このRhoAとRnd3の双安定な活性化機構(Bistability)が、ブレブが形成と退縮を繰り返す双安定性の本質であるという説を提唱しています(Aoki et al. PNAS 2016; Ikenouchi. Cell Cycle 2016)。しかしながら、ブレブが拡大する際にRnd3が活性化するメカニズムや、ブレブが拡大から退縮に転じる際の急峻なRnd3の不活性化とRhoAの活性化に関わる分子機構などシグナル伝達機構の中心的な部分が未解明のままです。本研究では、ブレブの分子メカニズムを実験と数理モデルの両面から解明することを目指します。
参考文献
- Aoki K, Maeda F, Nagasako T, Mochizuki Y, Uchida S, Ikenouchi J. A RhoA and Rnd3 cycle regulates actin reassembly during membrane blebbing. Proc Natl Acad Sci U S A. 2016 Mar 29;113(13):E1863-71.
- Shiomi R, Shigetomi K, Inai T, Sakai M, Ikenouchi J. CaMKII regulates the strength of the epithelial barrier. Sci Rep. 2015 Aug 18;5:13262.
- Ikenouchi J, Hirata M, Yonemura S, Umeda M. Sphingomyelin clustering is essential for the formation of microvilli. J Cell Sci. 2013 Aug 15;126(Pt 16):3585-92.
- Ikenouchi J, Umeda M. FRMD4A regulates epithelial polarity by connecting Arf6 activation with the PAR complex. Proc Natl Acad Sci U S A. 2010; 107:748-53.
- Ikenouchi J, Umeda K, Tsukita S, Furuse M, Tsukita S. Requirement of ZO-1 for the formation of belt-like adherens junctions during epithelial cell polarization. J Cell Biol. 2007; 176:779-86.
- Umeda K, Ikenouchi J (Co-first), Katahira-Tayama S, Furuse K, Sasaki H, Nakayama M, Matsui T, Tsukita S, Furuse M, Tsukita S. ZO-1 and ZO-2 independentrly determine where claudins are polymerized in tight-junction strand formation. Cell 2006; 126:741-54.
- Ikenouchi J, Furuse M, Furuse K, Sasaki H, Tsukita S, Tsukita S. Tricellulin constitutes a novel barrier at tricellular contacts of epithelial cells. J Cell Biol. 2005; 171:939-45.
- Ikenouchi J, Matsuda M, Furuse M, Tsukita S. Regulation of tight junctions during the epithelium-mesenchyme transition: direct repression of the gene expression of claudins/occludin by Snail. J Cell Sci. 2003; 116:1959-67.








