多重染色超解像顕微鏡法による細胞内シグナル伝達の空間マップの作成
 研究代表者
研究代表者
木内泰
京都大学大学院医学研究科 神経・細胞薬理学
http://www.pharm2.med.kyoto-u.ac.jp/
研究概要
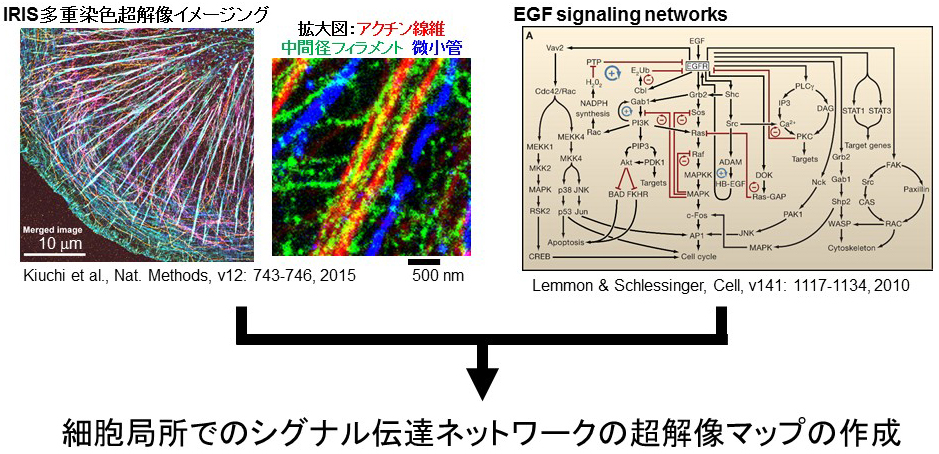
細胞内シグナル伝達は、数多くのシグナル分子の結合解離を基盤とした現象である。この現象の数理解析を難しくする問題として、多くのタンパク質の細胞内濃度や解離定数が未知なだけでなく、足場タンパク質や細胞内構造への局在や複合体形成による濃度や解離定数の変化が挙げられる。さらにこの局所的な濃度や解離定数の変化や複合体の分子構成が、細胞内シグナル伝達に空間的なネットワークを形成し、シグナル伝達に秩序と方向性を与えていると予想される。このことから細胞内シグナル伝達の実像を理解するために関連するシグナル分子群の局在や細胞内構造を同一の細胞で可視化することは重要である。
これまで私たちは、同一細胞で多種類のタンパク質を連続多重染色でき、高密度染色による精細な画質を実現した超解像顕微鏡法IRISを開発し、アクチン線維や微小管、中間径フィラメント、接着斑の細胞局所での近接性を調べてきた。本研究では、これらの細胞内構造に加えてEGFシグナル伝達に関わる分子群の可視化を行い、シグナル伝達の超解像マップを作成する。EGF受容体は、細胞膜全体に一様に分布しているにも関わらず、細胞外のEGFと結合するEGF受容体は、細胞の背側や細胞周縁の腹側に分布しているものに限定されている。さらに細胞内に取り込まれたEGF受容体を含む小胞やエンドソームには、多種類のシグナル分子が局在している。このため、細胞膜のEGF受容体や細胞内に取り込まれたEGF受容体を起点としたシグナル伝達には、空間的な偏りが存在すると推定される。さらにこのEGFと結合できるEGF受容体の分布や動態には、アクチン線維が関与しており、また接着斑近傍ではエンドサイトーシスが遅くなることも知られている。EGF刺激された細胞において、細胞膜で閉ざされた細胞質では、単純な反応拡散方程式で記述されるようにシグナル伝達が進むのではなく、おそらく膜構造や細胞骨格、接着構造といった空間的な構造情報を利用している。このEGF受容体を起点とするシグナル伝達分子群の空間的な位置情報と細胞内構造の超解像マップを作成することで、細胞内シグナル伝達のより実像に近い数理解析へと展開するための基盤を構築する。
参考文献
- 木内 泰、渡邊 直樹
超解像顕微鏡法IRISの開発による無制限多重染色と高精細な画質の実現、感染免疫炎症、46(2): 34-45, 2016 - 木内 泰、渡邊 直樹
高密度・多重染色超解像蛍光顕微鏡法IRISの原理と実践、生体の科学、67(3): 270-276, 2016 - Kiuchi T, Higuchi M, Takamura A, Maruoka M, Watanabe N
Multitarget super-resolution microscopy with high-density labeling by exchangeable probes., Nature Methods, 12: 743-746, 2015 - Kiuchi T, Ortiz-Zapater E, Monypenny J, Matthews DR et al.
The ErbB4 CYT2 variant protects EGFR from ligand-induced degradation to enhance cancer cell motility., Science Signaling, 7: ra78, 2014 - Higashida C, Kiuchi T, Akiba Y, Mizuno H, Maruoka M, Narumiya S, Mizuno K, Watanabe N
F- and G-actin homeostasis regulates mechanosensitive actin nucleation by formins., Nature Cell Biology, 15: 395-405, 2013 - Kiuchi T, Nagai T, Ohashi K, Mizuno K
Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension., J. Cell Biol., 193: 365-380, 2011 - Kiuchi T, Ohashi K, Kurita S, Mizuno K
Cofilin promotes stimulus-induced lamellipodium formation by generating an abundant supply of actin monomers., J. Cell Biol., 177: 465-476, 2007








