研究概要
- シナプスを介した情報のやりとりの重要さ
- シナプスを研究するには
- イメージングによって明らかになったシナプスの性質
- 発達過程においてシナプスは形成と除去を急速に繰り返す
- シナプス分子は密に詰まっているがその動態は大きい
- シナプス形成にはグリア細胞の補助が必要である
- シナプス形成の過程は多様である
- シナプスイメージングの疾患研究への応用
- これからのシナプス研究
- シナプス後部構造の定量的モデルの構築
- 生体内におけるシナプス分子・シナプス構造の挙動
I シナプスを介した情報のやりとりの重要さ
ヒトの行動は脳の働きによって規定されます。脳は多数の神経細胞が相互に情報をやりとりすることによってその機能を発揮します。神経細胞間での情報のやりとりを行う主要な構造はシナプスと呼ばれ、シナプスの性質が長期間安定に維持されることによってヒトの行動やこころの働きは安定した再現性のあるものとなります。一方でシナプスの性質が外界の刺激によって変化することで、ヒトの個性や経験による行動変化が引き起こされると考えられます。シナプスは従って「長期間安定に存在する」構造であると同時に、脳の機能変化の基盤として「急速に変化しうる」性質を併せ持っている必要があります。このシナプスのユニークな特性がどのような分子レベルでの機構によって成立しているのか、を知ることが当研究室の主要なテーマです。
II シナプスを研究するには
シナプスの構造と機能を解析するには、イメージングという研究手法が重要です。イメージング以外にも、シナプス研究においては脳からシナプス構造を単離してその生化学的性質を調べる手法や、神経細胞に由来する電気信号を検出する電気生理学的手法が広く利用されています。このような手法によってこれまでに数多くの重要なシナプスの性質が明らかにされてきましたが、生化学・電気生理学のどちらの手法の場合にも「単一のシナプス」に由来する構造や分子の情報を得ることは出来ませんでした。これに対してイメージングによるシナプス研究では、生きている神経細胞の一個のシナプスに由来する情報を、経時的に取得して解析することが可能です。我々がイメージングを用いたシナプス解析に重点を置くのはこのような理由からです。
III イメージングによって明らかになったシナプスの性質
それでは1個1個のシナプスに存在する分子が可視化できるようになったことで、シナプスのどのような「新しい性質」がわかってきたのでしょうか。以下にイメージングによって明らかになってきたシナプスの性質のいくつかを紹介します。
1.発達過程においてシナプスは形成と除去を急速に繰り返す
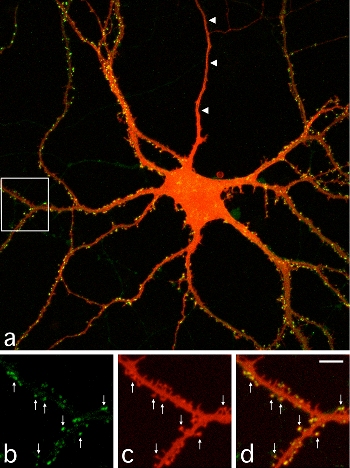 III-1 蛍光蛋白質(GFP)とPSD-95の融合蛋白質を発現した培養海馬神経細胞。細胞内のPSD-95-GFPの分布を緑色で、細胞形態を蛍光色素のDiI(赤)で示す。b, c, dはaの白四角内の拡大像。矢印はPSD-95の集積するスパイン構造を示す。 |
シナプスは一旦形成されれば非常に安定に存在する構造で、脳の発達の過程でもシナプスは単調に増えていき、その後で何らかの外界の刺激や感覚入力によって一部のシナプスが除去されていくと従来考えられてきました。培養した海馬神経細胞でシナプス密度を測定した場合にも、培養して1週間、2週間、さらに3週間とシナプス密度は増加していきます。しかしシナプスに局在する分子にGFPのラベルを付加して、単一シナプスでその寿命を測定すると、非常に多くのシナプスが一旦形成された後で再び除去されてしまいます。一日あたり1-2割のシナプスが形成・除去されることで全体のバランスが保たれていることになります。このバランスはわずかに形成が多くなるように調節されており、結果として全体ではシナプス密度がゆっくりと増えていきます。
またシナプスではシナプス前部から放出される神経伝達物質をシナプス後部にある神経伝達物質の受容体が受け取ることで情報伝達がおこります。大脳皮質や海馬などにおける主要な興奮性の神経伝達物質はグルタミン酸で、シナプス後部の細胞膜上にはグルタミン酸受容体(AMPA受容体、NMDA受容体、代謝型グルタミン酸受容体が主要な3種類の受容体になります)が集積しています。シナプス形成の際には、シナプス前部での伝達物質放出を担う分子、シナプス後部での受容体集積を制御する分子が局所に集まってきます。これらの分子集積とシナプス構造の形成過程を可視化する実験を行ったところ、シナプス形成は30分から数時間という短時間で一気に起きる現象であることが明らかになりました。
シナプスの形成過程を巨視的に観察した場合にはシナプス密度の増加が数週間の間にゆっくり進行するので、単一シナプスの形成と成熟も同じようなゆっくりとしたプロセスであるとこれまで考えられてきましたが、実際には全く異なったプロセスを経てシナプスが形成されていくことがわかります。
- Okabe, S., Kim, H., Miwa, A., Kuriu, T., and H. Okado. Continual remodeling of postsynaptic density and its regulation by synaptic activity. Nature Neuroscience, 2, 804-811, 1999.
- Okabe, S., Miwa, A., and H. Okado. Spine formation and correlated assembly of presynaptic and postsynaptic molecules. Journal of Neuroscience, 21, 6105-6114, 2001.
- Ebihara, T., Kawabata, I., Usui, S., Sobue, K., and S. Okabe. Synchronized formation and remodeling of postsynaptic densities: long-term visualization of hippocampal neurons expressing postsynaptic density proteins tagged with GFP. Journal of Neuroscience, 23, 2170-2181, 2003.
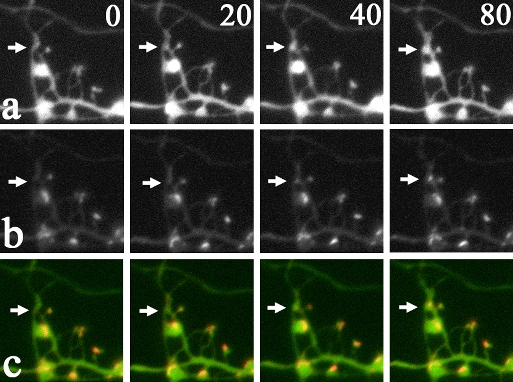 |
| III-2 短時間でのシナプス構造の形成。aはCFPの蛍光で樹状突起と軸索の形態を、bはYFPの蛍光でPSD-95-YFPの集積過程を示す。cは両者の重ね合わせ像。矢印は新しく出来たスパイン構造内にPSD-95-YFP分子が集積した部位を示す。数字は経過時間(単位は分)。 |
2. シナプス分子は密に詰まっているがその動態は大きい
シナプス構造とシナプス分子の動態を統一的に理解するには、分子の集合体であるシナプス後肥厚部(postsynaptic density:PSD)やシナプス前部における分子集積について、より定量的なモデルを提案する必要があります。このようなモデルを作成する際にまず必要となる情報は、シナプスに局在する分子の絶対数です。この目的の為にまずGFP分子一個の蛍光強度を蛍光ビーズの蛍光強度と比較して、蛍光ビーズのキャリブレーションを行いました。次に実際にシナプス分子とGFPの融合蛋白質を発現している神経細胞の標本に蛍光ビーズを添加して、蛍光強度の定量を行い、目的とするシナプスに機能的なGFP分子が何個程度存在するのかを推定しました。最後に蛍光蛋白質との融合分子を発現する細胞およびコントロールの細胞を染色して、相対的に融合分子発現細胞においてどの程度の過剰発現となっているのかを測定しました。これらのデータから最終的には融合分子を発現していない細胞でのシナプス分子の絶対数を求めました。この手法を利用してPSD-95を初めとする複数のシナプス後部蛋白質の絶対数があきらかになり、大体100-500程度の分子が単一シナプスに局在することがわかりました。この分子数をもとに比較的単純なシナプス後部のモデルを作成すると、PSD-95などの分子がシナプス後部においてかなりの密度で存在しており、膜状に存在するグルタミン酸受容体との相互作用が非常に高い頻度でおこりうることも明らかになりました。
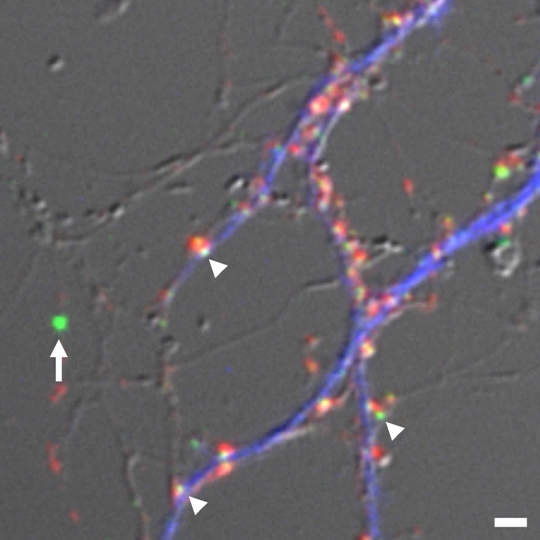 |
| III-3 GFP融合PSD蛋白質の絶対数の推定。GFP1分子でその蛍光強度をcalibrateした蛍光ビーズ(矢印)に対して、PSD-95-GFPを集積する単一シナプス(矢頭)の蛍光強度の相対値を求めることで、単一シナプスに存在するPSD-95-GFP分子の絶対数を推定することが出来る。シナプス前部(赤)と樹状突起(青)も免疫染色によって同定している。 |
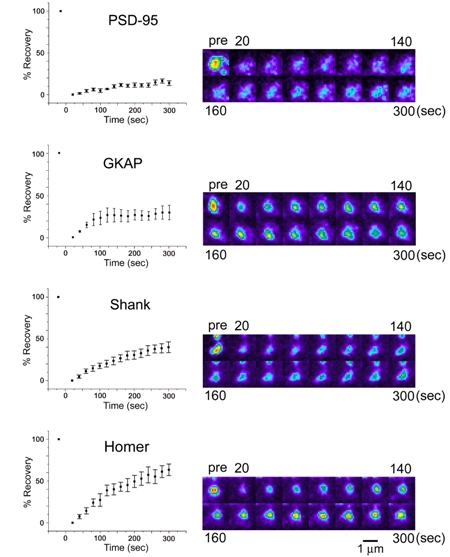 |
| III-4 蛍光消退法(FRAP)により測定したPSD分子のシナプス後部における交換速度。四種類のPSD足場蛋白質(PSD-95, GKAP, Shank, Homer)について、蛍光の回復速度を定量した。右が実際の単一シナプス由来の画像、左が蛍光強度を定量化したグラフ。5分以内に蛍光強度の回復が観察される。 |
それではシナプスに密に局在する分子自体の振る舞いにはどのような原則があるのでしょうか。蛍光消退法(fluorescence recovery after photobleaching; FRAP)と呼ばれる手法を用いて、単一シナプス内でのシナプス後部分子の動態を測定すると、分子レベルでのシナプスへの集積と分散の速度はシナプス自体の寿命に比較して更に速く、数分から数十分程度の速さであることがわかりました。従って一旦形成されたシナプスにおいてもその内部で分子の交換反応は常に進行しており、数時間程度待てばシナプス後部内の分子はほとんど新しい分子に置き換わってしまっていることになります。このようにシナプス分子が常に置き換わっているにもかかわらず、何故シナプス自体の様々な性質(たとえばシナプス伝達の効率など)は長期間一定に維持されるのでしょうか。これまでにイメージングを利用した実験で、シナプス後部の分子集積に関しては、細胞骨格であるアクチン線維が重要な制御因子となっていることが明らかになりました。シナプス後部分子とアクチン線維の間で起こる分子相互作用がシナプス構造の安定化に寄与していると考えられます。
- Sugiyama, Y., Kawabata, I., Sobue, K., and S. Okabe Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods 2, 677-684, 2005.
- Okabe, S., Urushido, T., Konno, D., Okado, H., and K. Sobue. Rapid redistribution of the postsynaptic density protein PSD-Zip45 (Homer 1c) and its differential regulation by NMDA receptors and calcium channels. Journal of Neuroscience, 21,9561-9571, 2001.
- Kuriu, T., Inoue, A., Bito, H., Sobue, K., and S. Okabe Differential control of postsynaptic density scaffolds via actin-dependent and independent mechanisms. Journal of Neuroscience 26, 7693-7706, 2006.
3. シナプス形成にはグリア細胞の補助が必要である
単一シナプスを可視化する手法は、シナプス内部で起きる出来事を解析するだけでなく、シナプス構造とその外部環境の相互作用を調べる目的にも使えます。シナプス近傍に存在してシナプスの形成・維持過程を制御する可能性のある構造としては、アストログリア細胞の突起をまず挙げることが出来ます。海馬のスライス培養で神経細胞とアストログリアに別々の蛍光標識を導入することで、発達過程の海馬におけるアストログリアの突起と樹状突起上のスパイン構造の接触過程を同定することが可能になりました。この手法を用いてアストログリアの接触という出来事と、それ以降のスパインの安定化・成熟過程の関連を解析すると、アストログリアが接触することでスパインはより安定化し、その形態も成熟することがわかりました。1個のアストログリア細胞は組織内で他のアストログリアに対して排他的な領域を形成し、しかも1個の細胞で数千個以上のシナプスと自分の領域内で接触することがわかっています。したがってアストログリアのシナプスに対する制御能はきわめて複雑かつ広範であると考えられます。
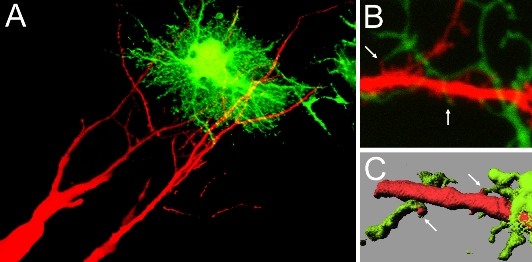 |
| III-5 アストログリアと樹状突起スパインの接触。Aに示すように海馬の錐体細胞に色素(赤)を導入し、アストログリア細胞にGFP(緑)を発現させて、両者が接触する部位を同定している。Bは二光子顕微鏡による光学的断層面を示す。矢印はスパイン(赤)とアストログリアの突起(緑)の接触部位を示す。Cはsurface renderingによって二光子画像から再構築した樹状突起(赤)およびアストログリア(緑)の立体構造。矢印は両者の接する部位を示す。 |
- Nishida, H. and S. Okabe Direct astrocytic contacts regulate local maturation of dendritic spines. Journal of Neuroscience 27, 331-340, 2007.
4. シナプス形成の過程は多様である
イメージングによるシナプス形成過程の研究は、これまで主に海馬と大脳皮質の興奮性シナプスを材料として行われてきましたが、それ以外のシナプスについてイメージングによる解析を行うと、全く新しいシナプス形成の分子機構が見つかってくる場合があります。一つの例は海馬や大脳皮質に存在する介在神経細胞(抑制性の神経細胞でGABAを神経伝達物質として放出)の樹状突起に形成される興奮性シナプスの後部構造です。介在神経細胞自体は抑制性の伝達物質であるGABAを放出しますが、この細胞を興奮させるためのシナプスはグルタミン酸を伝達物質として用い、そのシナプス後部は興奮性の錐体細胞と似た構造・分子組成を持っています。しかし、この細胞のシナプスをイメージングした所、生後の発達早期にシナプスが樹状突起上を移動していくことがわかりました。このシナプスの移動は微小管をレールとして起こっており、分子モーターであるダイニンとその調節分子であるLis1が必要でした。このような現象はこれまで知られておらず、全く新しいシナプス位置の調節機構だと考えられます。
また小脳のプルキンエ細胞と顆粒細胞の軸索(平行線維)との間に形成されるシナプスの発達過程を観察した所、平行線維がプルキンエ細胞のスパインと接触した場所から、微小な突起が形成され、この軸索側の突起がスパインを包囲する構造を形成することが、シナプスの成熟に重要であることもわかりました。スパインを包囲する軸索側の突起の形成には、軸索から放出されるcbln1分子が必須であり、シナプス誘導因子は軸索の構造変化も誘導することがわかりました。
既に詳細な研究が進んでいる海馬や大脳皮質の錐体細胞のスパインシナプスに関しても、これまでには知られていなかった新しいシナプス制御メカニズムが解明されつつあります。微小管結合蛋白質であるDCLK1は、非常に強い微小管の重合促進作用と安定化作用を持ちますが、その神経細胞での局在は発達早期には樹状突起の先端に特異的に見られます。このようなDCLK1の局在により、樹状突起先端での微小管の重合促進が起こり、突起の伸長が促進されるのですが、一方でDCLK1はスパインの成長やシナプス後部への分子集積を阻害する作用を持つことも明らかになりました。すなわちDCLK1は樹状突起の成長促進とシナプス成熟の抑制、という二つの機能を突起先端で発揮することで、樹状突起の部位特異的な機能のコントロールを行っているのだと考えられます。
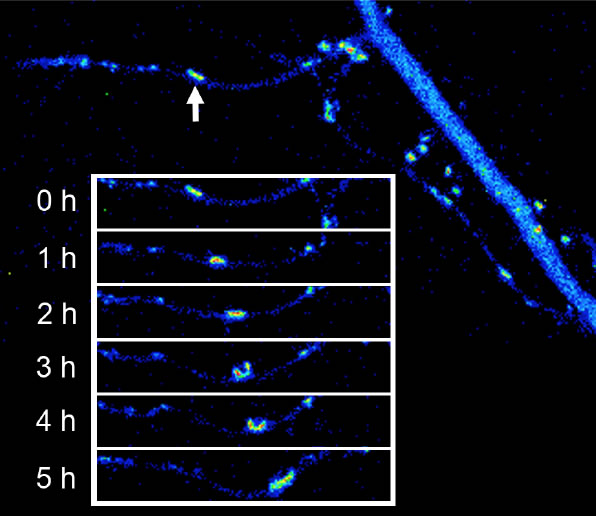 |
| III-6 抑制性神経細胞の樹状突起に形成される長いフィロポディア様の突起に沿って逆行性に移動するPSD-95-GFPのクラスター。このような長いフィロポディア様の突起は抑制性神経細胞に特異的で、神経細胞が成熟すると失われてしまう。シナプスは最終的には樹状突起のシャフトに到達して、その後は動的な位置の変化は見られなくなる。 |
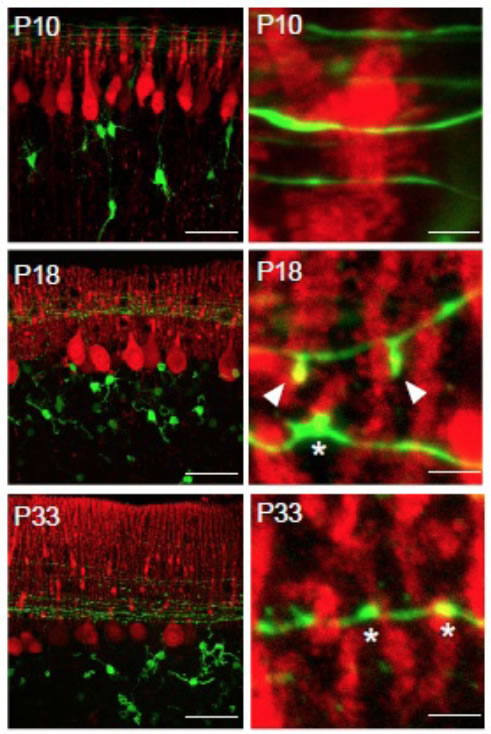 |
| III-7 小脳の発達過程における平行線維(GFP発現、緑)とプルキンエ細胞(calbindin染色、赤)の間に形成されるシナプス構造の変化。生後18日頃に特異的に、平行線維から微小な突起が形成されてプルキンエ細胞と接触する。 |
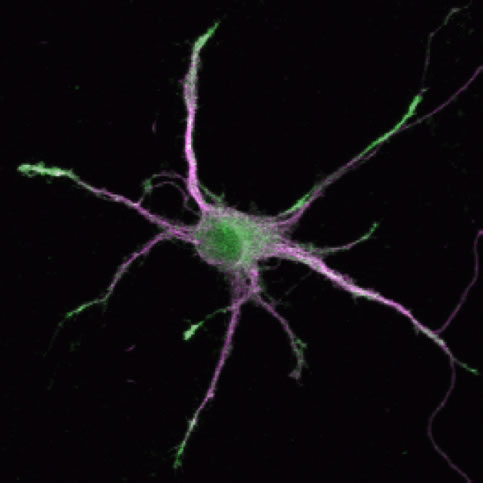 |
| III-8 DCLK蛋白質は樹状突起の先端に濃縮し、この部分での突起伸長を促進する。一方でDCLKにより樹状突起先端は軸索とシナプスを形成することから逃れ、動的な状態を維持する。緑:DCLK蛋白質、マジェンタ:樹状突起マーカーのMAP2の分布をそれぞれ示す。 |
- Kawabata, I., Kashiwagi, Y., Obashi, K., Ohkura, M., Nakai, J., Wynshaw-Boris, A., Yanagawa, Y., and S. Okabe LIS1-dependent retrograde translocation of excitatory synapses in developing interneuron dendrites. Nature Communications 3, 722, 2012.74.
- Ito-Ishida, A., Miyazaki, T., Miura, E., Matsuda, K., Watanabe, M., Yuzaki, M and S. Okabe Presynaptically released Cbln1 induces dynamic axonal structural changes by interacting with GluD2 during cerebellar synapse formation. Neuron 76, 549-564, 2012.
- Shin, E., Kashiwagi, Y., Kuriu, T., Iwasaki, H., Tanaka, T., Koizumi, H., Gleeson, J. G. and S. Okabe Doublecortin-like kinase enhances dendritic remodeling and negatively regulates synapse maturation. Nature Communications 4, 1440, 2013.
IV シナプスイメージングの疾患研究への応用
シナプスの動態をイメージングにより解析する技術は個体レベルでの二光子顕微鏡によるシナプスイメージングが発展してきたことにより、精神神経疾患のモデル動物でのシナプス障害の解析に応用できるようになりつつあります。精神神経疾患の中でも自閉スペクトラム症は社会性の障害や興味が強く限定されるなどの症状が生後早期から現れる疾患であり、かつ疾患遺伝子の解析からシナプスに局在する分子との関連性が疑われている疾患です。自閉スペクトラム症のモデル動物として確立されたものは既に多く存在していますが、これらの動物モデルに共通にシナプスの変化が見られるかどうかはこれまで知られていませんでした。我々は3種類の遺伝学的背景の異なる自閉症モデルマウスを対象として二光子顕微鏡によるシナプスイメージングを個体レベルで行い、これらのモデルマウスに共通に見られる変化として、シナプスが過剰に形成され、それが壊されていくことを発見しました。このような変化が自閉症モデル動物に共通の神経回路の変化として確定すれば、疾患の病態生理を理解する上で大きな進歩となります。
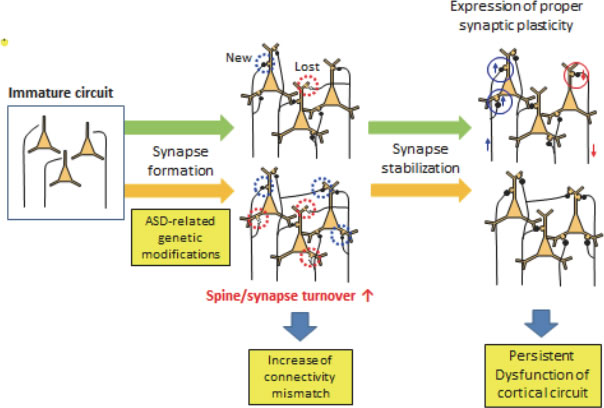 |
| IV-1 自閉症モデルマウスで起こっている神経回路の変化。色々な遺伝的因子によりシナプスの形成と除去が過剰となり、それに伴って神経回路のつながりのミスが増加し、回路機能が低下する。 |
- Isshiki, M., Tanaka, S., Kuriu, T., Tabuchi, K., Takumi, T. and S. Okabe
Enhanced synapse remodelling as a common phenotype in mouse models of autism.
Nature Communications 5, 4742, 2014. doi: 10.1038/ncomms5742.
V これからのシナプス研究
以上述べてきたように、イメージングという手法で単一シナプスの構造や分子集積を直接観察・解析することが出来る様になって、シナプスの分子細胞生物学は飛躍的に進歩しました。上に述べた研究成果は私達の研究グループのシナプス後部の足場蛋白質に関する仕事を中心にしたものですが、それ以外にもシナプス前部におけるシナプス小胞の振る舞いや、シナプス後部における受容体分子の形質膜内での運動やシナプス膜への組み込み過程など、分子の多様な動態が明らかになりました。これらの成果を元にして、シナプス研究の次のステップとして重要な課題は次の三つだと思います。
1. シナプス後部構造の定量的モデルの構築
シナプス後部に存在する分子についてはほぼその全貌が明らかになりました。一方で前述したようにシナプス後部に存在する分子の定量的な解析手法も開発されています。これらのデータに、更にシナプス分子の交換速度についてのデータを加えれば、分子集合体としてのシナプス後部構造についての定量的なモデルを作成することが可能です。電気生理学などの機能的な解析手法を用いた場合、シナプス後部における様々な機能変化は、そのダイナミックレンジがせいぜい150-300%程度であることが知られています。このような機能変化を説明するには、分子構築についてのモデルも高い定量性を持っていることが必要とされます。また様々なシナプス後部分子を過剰発現、あるいは発現抑制した場合のシナプスに見られる表現型についても、定量的モデルを用いて説明することが出来る筈です。さらにこのような分子集合体についてのモデルから得られる一般法則は、他の様々な細胞内分子集合体について同様の定量化を行う際にも役立つでしょう。
2. 生体内におけるシナプス分子・シナプス構造の挙動
これまでのシナプス研究は分散培養系やスライス培養系などの、生体から取り出した人工的なシステムでの解析が主体でした。これに対して生きた動物個体の中での分子動態についてはほとんどデータがありません。実際に動物個体内で神経回路の機能が成熟していく過程で、どのようなシナプス機能・構造の変化が引き起こされるのか、この疑問に答えることは次の重要なステップです。現時点では大脳皮質の比較的浅い層のシナプス構造を蛍光蛋白質で可視化することが可能になっていますが、イメージング技術や遺伝子組み換え動物の進展によって、様々な脳組織におけるシナプスの機能と構造の解析が可能になると予想されます。更に脳内でのシナプス活動を積極的に操作する技術が開発できれば、シナプスの機能と動物の行動との関連を直接的に理解することが可能になるでしょう。






